打破海外专利垄断,HRD检测产品进入创新医疗器械特别审查通道 |
||||
|
||||
| 【关键词】:打破,海外,专利,垄断,检测,产品,进入,创新,医疗 【作者】:admin 【来源】:中国网 | ||||
|
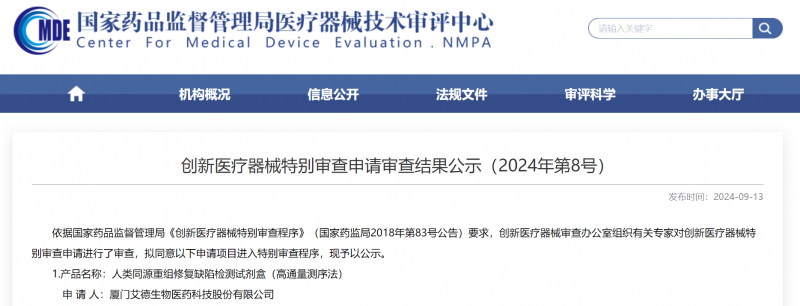
近日,国家药监局发布公示,来自厦门的国家制造业单项冠军、肿瘤精准诊断上市龙头企业——艾德生物自主创新产品(“人类同源重组修复缺陷检测试剂盒”,简称:“HRD试剂盒”)进入创新医疗器械特别审查通道。据悉,这已经是艾德生物的第三个“创新医疗器械”产品,也是我国目前唯一进入该通道的HRD试剂盒。 (国家药监局创新医疗器械特别审查申请审查结果公示) 创新医疗器械特别审查是专为那些具有我国发明专利、技术上国内首创、国际领先且具有显著临床应用价值的医疗器械而设的“绿色通道”。国家药监局在标准不降低、程序不减少的前提下,对创新产品优先予以审查,为临床急需产品”单独排队,一路快跑“。 自2014年国家药监局推出创新医疗器械特别审查程序以来,这一通道便成为各大医疗器械产品竞争的高地,但其高门槛和严苛的审查标准也让不少企业望而却步。2023年,国家药监局共收到创新医疗器械特别审查申请466项,仅有69项获准进入创新医疗器械特别审查程序,这种稀缺,反映了国家药监局对这项审查的严苛程度以及对产品创新价值的审慎考量。 艾德生物这款HRD试剂盒的研发历程,是一部充满挑战与持续创新的史诗。 卵巢癌又被称为“妇癌之王”,在过去二十多年中,卵巢癌的药物治疗主要依赖于铂类药物进行化疗,后来虽加入紫杉烷类药物进行联合治疗,但总体生存率并未有明显提高,多数患者无法活过五年。 2017年,第一款PARP靶向药物“奥拉帕利”的上市,打破了我国卵巢癌的治疗局限,让越来越多患者跨越了5年生存大关!和所有靶向药物一样,PARP靶向药物也是有筛选条件的,并非对所有卵巢癌患者都有效。以奥拉帕利为例,我国已获批其单药用于携带胚系或体细胞BRCA突变晚期卵巢癌以及联合贝伐珠单抗用于同源重组修复缺陷(HRD)阳性晚期卵巢癌的一线维持治疗,并已纳入医保报销。可见,卵巢癌PARP靶向治疗前必须检测BRCA1/2基因突变和HRD状态。 BRCA1/2基因检测是卵巢癌精准治疗的起点,我国药监局已于2019年批准了同样来自艾德生物的“人类BRCA1基因和BRCA2基因突变检测试剂盒”上市,用于PARP靶向用药前的检测。 HRD能够筛选出更广的PARP靶向治疗获益人群,但国内尚无产品获批。基于临床”刚需“,艾德生物在BRCA检测基础上,进行技术跃升和产品升级。 不同于BRCA,HRD检测需要特定的算法来揭示基因的特征,评估其状态。在该算法领域,少数西方企业长期掌握着核心技术专利,形成了较高的壁垒。为了突破这一限制,艾德生物提早布局,在BRCA1/2试剂盒获批后即投入大量资源,开展HRD自主专利技术的研发。5年间团队进行了超过6000次的测试,通过对海量数据的深度研究,最终开发出了更为精准、覆盖面更广的ADx-GSS?基因组瘢痕算法,彻底打破了西方企业的垄断。该算法覆盖了更广泛的癌种,且在考虑人种差异的同时,补充了我国患者人群位点,满足国内外临床使用需求。不仅如此,艾德生物结合另一项自主专利技术——ADx-HANDLE?,让检测操作更简便、更快速,大大缩短患者等待时间,开发出可在院内开展的HRD检测产品,为卵巢癌患者提供了更为精准、高效的诊疗方案。 从BRCA到HRD,是技术上的突破,展现了中国企业在科技创新方面的实力;更是艾德生物深耕肿瘤精准诊断,创新发展的缩影,企业至今已有29款自主创新产品获批上市,已用新质生产力创新成果服务数百万肿瘤患者,全面满足肿瘤精准治疗的诊断需求。 关于艾德生物 艾德生物扎根厦门海沧生物医药港,2017年在创业板上市,是行业公认的肿瘤精准检测龙头企业,是国家企业技术中心、专精特新小巨人企业、国家制造业单项冠军企业。企业拥有70多项自主专利,突破跨国企业技术垄断,获批上市多个行业领先的创新产品,荣获国家科学技术进步二等奖、中国专利银奖等。产品覆盖各大癌种的精准检测,多个产品至今未有竞品获批上市,产品还在日本、韩国、欧盟获批上市并纳入日韩医保,在全球70多个国家和地区广泛使用。企业与阿斯利康、强生、安进、礼来、默克、恒瑞、百济神州、海和等国内外80多家知名药企达成战略合作,成功助力多个重磅靶向药在国内外加速批准,让“中国智造,迈向全球”,引领全球肿瘤精准诊疗高质量发展。 (推广) |